¿Que es el punto crítico de una sustancia?
En ingeniería química, muchas operaciones se diseñan alrededor de “fronteras” bien conocidas: hervir, condensar, disolver, separar. Pero cuando una sustancia se aproxima a su punto crítico, esas fronteras dejan de tener sentido. La línea que separa líquido y gas se difumina hasta desaparecer y el fluido entra en un régimen donde pequeñas variaciones de presión y temperatura cambian de forma notable su comportamiento. Entender qué ocurre en ese umbral —y por qué cada sustancia tiene un par único de valores (Tc, Pc)— es clave para interpretar y controlar procesos que trabajan en condiciones límite.
Este artículo explica qué es el punto crítico, cuáles son sus características físicas más relevantes y en qué se diferencia de un cambio de fase convencional. A partir de ahí, aterriza el concepto en los fluidos supercríticos más utilizados —CO₂, agua y varios hidrocarburos— para conectar sus propiedades con utilidades industriales concretas, desde la extracción y el secado hasta tecnologías de oxidación y valorización de residuos.
¿Qué es el punto crítico de una sustancia?
El punto crítico de una sustancia es la condición termodinámica definida por una temperatura crítica (Tc) y una presión crítica (Pc) en la que las fases líquida y gaseosa dejan de comportarse como estados diferenciados. En ese umbral desaparece la frontera de coexistencia líquido-vapor y el fluido pasa a describirse como una única fase, sin separación macroscópica entre ambas.
El punto crítico se expresa como el par de valores (Tc, Pc).
Se trata de una propiedad específica de cada sustancia. Sus valores dependen de la estructura molecular y de las interacciones intermoleculares del compuesto, por lo que no existe un punto crítico universal ni extrapolable entre materiales distintos. Esta singularidad convierte al punto crítico en una referencia útil para interpretar el comportamiento de los fluidos cuando operan cerca de condiciones límite de presión y temperatura.
Características del punto crítico de una sustancia
El estado crítico se reconoce por varios rasgos que lo separan de un cambio de fase convencional. No se trata de una transición líquido-vapor con coexistencia estable, sino del límite a partir del cual esa distinción deja de estar definida.
- Extinción de la coexistencia líquido-vapor
En el umbral crítico termina la curva de equilibrio que separa las regiones de líquido y vapor. A partir de ahí no hay dos fases en equilibrio con una interfase estable, por lo que desaparece la transición definida entre ambas. - Pérdida progresiva de la distinción macroscópica
Al aproximarse a esa condición, las propiedades que permiten identificar líquido y vapor se van igualando hasta volverse indistinguibles a escala macroscópica. El cambio es continuo, sin salto abrupto comparable al de una ebullición a presión fija. - Determinación por un par único de valores (Tc, Pc)
La condición crítica queda fijada por una combinación concreta de temperatura y presión. No es un parámetro ajustable ni transferible entre sustancias, ya que depende de la estructura molecular y del tipo e intensidad de las interacciones intermoleculares. - Respuesta amplificada ante pequeñas variaciones de P y T
En las inmediaciones críticas, cambios pequeños en presión o temperatura generan variaciones desproporcionadas en el estado del sistema. Esta sensibilidad condiciona tanto su descripción termodinámica como la estabilidad cuando se opera cerca de esos valores. - Fluctuaciones críticas a gran escala
Cerca del umbral aparecen fluctuaciones intensas de densidad (y, en mezclas, también de composición) que se extienden a escalas crecientes. En términos físicos, aumenta la correlación espacial y se reduce la presencia de una longitud característica que limite regiones homogéneas. - Manifestaciones macroscópicas observables
Estas fluctuaciones pueden hacerse visibles mediante fenómenos como la opalescencia crítica, asociada a la dispersión de la luz por inhomogeneidades de densidad en el fluido. Es una señal experimental del comportamiento colectivo del sistema en ese régimen.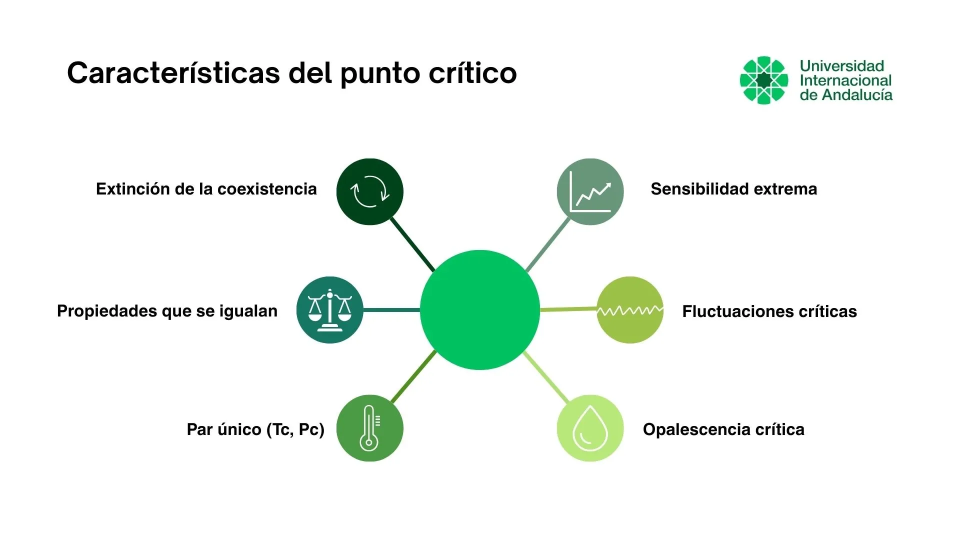
Diferencia entre el punto crítico y un cambio de fase convencional
Un cambio de fase convencional líquido–vapor ocurre cuando, a una presión y temperatura dadas, el sistema pasa de una fase a otra mediante una transición definida. En esas condiciones pueden coexistir líquido y vapor separados por una interfase, y el proceso implica un intercambio energético característico asociado a la transición.
En el entorno crítico, esa descripción deja de ser válida. Al aproximarse a la condición crítica, las diferencias entre líquido y vapor se reducen hasta desaparecer y la curva de coexistencia llega a su término. No hay dos fases en equilibrio ni una interfase estable, sino un límite a partir del cual el fluido se describe como una única fase continua.
Sustancias en estado supercrítico y sus utilidades
CO₂ supercrítico
El CO₂ entra en régimen supercrítico por encima de su temperatura crítica (Tc = 304,13 K) y su presión crítica (Pc = 7,377 MPa), lo que sitúa su operación en un rango industrial relativamente accesible (aprox. 31,0 °C y 73,8 bar).
Propiedades relevantes en régimen supercrítico
- Densidad ajustable
- Baja viscosidad
- Difusividad relativamente alta
- Secado sin interfaz líquido–vapor
Condicionantes de uso
- Polaridad: solubilidad limitada para solutos muy polares sin modificadores.
- Operación: necesidad de alta presión, con impacto en equipos, seguridad y control.
Para ver cómo estas propiedades se traducen en aplicaciones industriales concretas, puede consultarse el artículo CO₂ supercrítico: qué es y cómo se aplica en la industria.
Agua supercrítica
El agua opera en régimen supercrítico por encima de Tc = 647,096 K y Pc = 22,064 MPa, es decir, aproximadamente 374 °C y 221 bar. Son condiciones severas y determinan, desde el inicio, requisitos altos de materiales y diseño de equipo.
Propiedades relevantes en régimen supercrítico
- Menor polaridad efectiva
- Baja viscosidad y difusividad más alta
- Variación intensa de propiedades térmicas cerca del crítico
- Baja solubilidad de sales
Condicionantes de uso
- Operación
- Materiales y ensuciamiento
Propano supercrítico
El propano alcanza el régimen supercrítico por encima de su temperatura crítica (Tc ≈ 369,9 K) y su presión crítica (Pc ≈ 4,25 MPa), equivalentes a aproximadamente 96,8 °C y 42 bar. Estas condiciones, más moderadas que las del agua y comparables en presión a otros fluidos industriales, explican su uso como disolvente supercrítico apolar en aplicaciones específicas.
Propiedades relevantes en régimen supercrítico
- Alto poder disolvente para compuestos apolares
- Selectividad elevada frente a matrices complejas
- Baja viscosidad y buena capacidad de penetración
- Recuperación sencilla del disolvente
Condicionantes de uso
- Inflamabilidad: el propano es un hidrocarburo inflamable, lo que impone requisitos estrictos de seguridad, diseño ATEX y control de atmósferas.
- Aplicabilidad limitada a solutos apolares: su utilidad se restringe a compuestos de naturaleza lipofílica; no resulta adecuado para solutos polares sin estrategias adicionales.
Etano supercrítico
El etano alcanza el régimen supercrítico por encima de su temperatura crítica (Tc ≈ 305,3 K) y su presión crítica (Pc ≈ 4,88 MPa), lo que corresponde aproximadamente a 32,2 °C y 48,8 bar. Estas condiciones, moderadas desde el punto de vista industrial, explican su interés como fluido supercrítico en aplicaciones específicas de separación y procesado.
Propiedades relevantes en régimen supercrítico
- Disolvente apolar con mayor poder de solvatación que el CO₂
- Selectividad ajustable mediante presión y temperatura
- Baja viscosidad y buena penetración en sólidos
- Separación sencilla del disolvente
Condicionantes de uso
- Inflamabilidad: el etano es altamente inflamable, lo que exige diseños con criterios estrictos de seguridad y control de atmósferas.
- Uso especializado: su aplicación se restringe a procesos donde se requiere un disolvente apolar más potente que el CO₂ y se justifica el mayor compromiso en seguridad.
Butano supercrítico
El butano entra en régimen supercrítico por encima de su temperatura crítica (Tc ≈ 425,1 K) y su presión crítica (Pc ≈ 3,796 MPa), equivalentes a aproximadamente 152 °C y 38 bar.
Propiedades relevantes en régimen supercrítico
- Disolvente apolar con alta afinidad por fracciones lipofílicas
- Selectividad sobre matrices complejas
- Baja viscosidad y buena penetración en sólidos
- Recuperación por despresurización
Condicionantes de uso
- Seguridad: el butano es inflamable; su uso obliga a diseño y operación con criterios estrictos de prevención de atmósferas explosivas.
- Alcance químico: su utilidad se concentra en solutos apolares; no es una opción eficiente para fracciones polares sin estrategias adicionales.
Usos más habituales
|
Sustancia en estado supercrítico |
Usos más habituales |
Tecnologías donde se aplica |
|
CO₂ supercrítico |
Extracción y fraccionamiento de aromas, fragancias y compuestos bioactivos; secado de materiales porosos |
Extracción con fluidos supercríticos (SFE); secado supercrítico; procesado de materiales avanzados |
|
Agua supercrítica |
Oxidación y destrucción de residuos orgánicos; valorización de biomasa húmeda |
Oxidación en agua supercrítica (SCWO); gasificación hidrotermal / en agua supercrítica (SCWG) |
|
Propano supercrítico |
Extracción selectiva de aceites, grasas y ceras |
Extracción supercrítica apolar; fraccionamiento de lípidos en matrices naturales |